الکترولیت یک ماده رسانا به دلیل وجود یون های متحرک است . الکترولیت های مایع و جامد وجود دارد . الکترولیتهای مایع میتوانند نمکهای مذاب باشند که فقط از یونها تشکیل شدهاند یا محلولهای یونی که در آن نمک در یک حلال قطبی مانند آب حل میشود . الکترولیت های جامد بلورهایی هستند که در آنها برخی از یون ها متحرک یا پلیمرهایی مانند آنهایی هستند که در غشاهای تبادل یونی استفاده می شوند .
به عنوان مثال: نمک خوراکی ( کلرید سدیم ، سدیم کلرید) که با حل شدن در آب به یون تجزیه می شود . یک ماده غیر الکترولیتی وقتی در آب حل می شود، جریان الکتریکی را هدایت نمی کند. به عنوان مثال: شکر (مانند گلوکز ) پس از حل شدن در آب به یون تجزیه نمی شود. بنابراین هنگامی که یک بار در حال حرکت است یک جریان تولید می شود. الکتریسیته به طور سنتی از حرکت الکترون ها تولید می شود . در اینجا نیز همین اصل صدق می کند، اما به جای حرکت الکترون ها، یون ها در محلول هستند.
محلول الکترولیت محلولی حاوی یون است. جریان را هدایت می کند و از نظر الکتریکی خنثی است.
یک محلول الکترولیت آبی با حل کردن ماده ای به نام ” املاح ” در آب ساخته می شود. محلول الکترولیت آلی محلول رسانایی است که حاوی مولکول های کربن و مواد معدنی مختلف است .

تاریخچه الکترولیت
این پدیده تفکیک الکترولیتی است که نظریه آن توسط سوانت آگوست آرنیوس در سال 1887 فرموله شد و سپس توسط پیتر دبی و اریش هوکل تکمیل شد که رسانایی الکترولیتی را توضیح می دهد. این نظریه توسط گیلبرت نیوتن لوئیس تکمیل شد . [مرجع. لازم]
یون ها و ترکیبات یونی الکترولیت
اتم ها و مولکول ها از نظر الکتریکی خنثی هستند، اما می توانند به ذرات باردار الکتریکی به نام یون تبدیل شوند. دومی ها از ماده ای حل شده در آب می آیند که به کاتیون (ها) و آنیون (ها) تجزیه شده است.
تفکیک الکترولیتی مواد در محلول الکترولیت
الکترولیت ضعیف ماده ای است که تا حدی در آب تجزیه می شود. خود محلول «الکترولیت ضعیف» نامیده می شود. اسیدهای ضعیف ، مانند اسید استیک ، که تنها حدود 1 درصد از مولکولهای آن در آب تجزیه میشوند و یونها را تشکیل میدهند، الکترولیتهای ضعیفی هستند زیرا کاملاً یونیزه نشدهاند . همچنین برخی از نمکها وجود دارند که الکترولیتهای ضعیفی را تشکیل میدهند، مانند کلرید جیوه (II) ، زیرا فقط تا حدی در محلول آبی یونیزه میشود.
برخلاف الکترولیت ضعیف، الکترولیت قوی تقریباً به طور کامل در آب یونیزه می شود (تفکیک می کند). خود محلول “الکترولیت قوی” نامیده می شود.
بنابراین تفاوت بین یک الکترولیت قوی و یک الکترولیت ضعیف به درجه تفکیک مواد محلول در آب مربوط می شود.
جدول زیر خانواده های مختلف الکترولیت 1 را نشان می دهد :
| الکترولیت های قوی | الکترولیت کم | |
|---|---|---|
| اسیدها | اسیدهای قوی : غیر آلی: اسید پرکلریک (HClO4 ) ، اسید نیتریک (HNO3)، اسید سولفوریک (H2SO4 ) ، اسید کلریدریک ( HCl ) ، اسید هیدروبرومیک ( HBr ) ، اسید هیدریدیک ( HI)، اسید کلریک (HClO3) . اسید برومیک (HBrO 3 ) |
اسیدهای ضعیف : بسیاری از مواد معدنی: اسید گوگرد (H2SO3 ) ، اسید کربنیک ( H2CO3 ) ، اسید بوریک ( H3BO3 ) ، سولفید هیدروژن ( H2S ) بیشتر مواد آلی |
| مبانی | بازهای قوی : غیر آلی: هیدروکسیدهای قلیایی و هیدروکسیدهای قلیایی خاکی |
پایه های ضعیف : آمونیاک اکثر مواد آلی |
| نمک ها | اکثر | برمیدها ، یدیدها ، سیانیدها جیوه ، روی و کادمیوم تیوسیانات _ |
هدایت الکتریکی الکترولیت
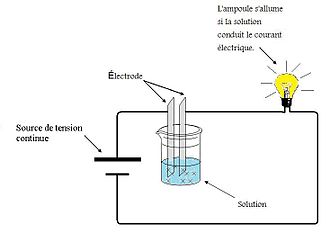
تصویر دستگاهی را نشان می دهد که برای نشان دادن رسانایی الکتریکی محلول ها استفاده می شود. با استفاده از این دستگاه می توان نشان داد که محلول های آبی برخی از مواد رسانای الکتریکی هستند یا خیر. این شامل قرار دادن دو الکترود در محلول x است . هنگامی که مدار بسته می شود، اگر محلول جریان را رسانا نکند، چراغ خاموش می ماند و اگر اجازه عبور جریان را بدهد، روشن می شود. شدت نور بسته به قدرت الکترولیت متفاوت است.
الکترولیت های طبیعی
برخی از الکترولیت ها طبیعی نامیده می شوند. در واقع، الکترولیت های خاصی در شبکه خون وجود دارند . سپس از ” الکترولیت های خون ” صحبت می کنیم. برخی دیگر در عرق وجود دارند زیرا حاوی عناصر الکترولیت مانند پتاسیم است . الکترولیت ها نقش بسیار مهمی در بدن ما دارند و عملکرد صحیح آن را تضمین می کنند. هر یک از این الکترولیت ها عملکرد مشخصی دارند و در مکان های مختلفی مانند پلاسمای خون یا مایع بینابینی که سلول ها را در بر می گیرد و مایع خارج سلولی را می سازد، یافت می شود .
الکترولیت های اصلی
بدنام ترین الکترولیت ها عبارتند از:
- آب نمک ( محلول آبی نمک غذا ، NaCl ) ، از نظر تاریخی اولین الکترولیت مورد استفاده (در باتری Volta در سال 1800 ).
- محلول های اسید سولفوریک ، مورد استفاده در باتری های اسید سرب .
- محلول های پتاس 5 تا 8 مولار ، مورد استفاده در باتری های قلیایی Ni-Cd یا Ni-MH .
- محلول های LiPF 6 در مخلوطی از حلال های آلی از نوع کربنات که در باتری های لیتیوم یون استفاده می شود .
- محلول های سولفات مس ، روی یا نیکل در یک محیط اسید سولفوریک که برای پوشش های الکترولیتی با آند محلول استفاده می شود .
- نمک های مذاب بر پایه آلومینا و کرایولیت که برای الکتروسنتز آلومینیوم استفاده می شود ( به مقاله مفصل تولید آلومینیوم با الکترولیز مراجعه کنید ).