由于存在 移动离子,电解质是 一种 导电材料。电解质 有液体 和 固体之分。液体电解质可以 是 仅由离子组成的 熔盐,也可以 是 盐 溶解在极性溶剂(例如水)中的 离子溶液。固体电解质是其中一些离子可以移动的晶体 , 或者 是离子交换膜中 使用 的聚合物。
例如: 食盐 ( 氯化钠、氯化钠) 溶解在水中时 会分解成离子 。非电解质溶解在水中时不导电。例如:糖(如葡萄糖)溶于水后不会离解成离子。因此,当电荷移动时就会产生电流。传统上,电力是通过电子的运动产生的。同样的原理也适用于此,但不是电子移动,而是离子在溶液中。
电解质溶液是含有离子的溶液。它传导电流并且呈电中性。
电解质水溶液 是通过将称为“溶质” 的物质 溶解在水中而制成的。有机电解质溶液 是含有 碳 分子和各种矿物质 的导电溶液 。

电解质的历史
它是电解质离解的现象 ,其理论由 斯旺特-奥古斯特·阿伦尼乌斯 于1887年提出,后来由 彼得·黛比 和 埃里希·赫克尔完成 ,解释了电解质的电导率。 该理论 由吉尔伯特·牛顿·刘易斯完成。 [参考。必要的]
离子和电解质离子化合物
原子和分子是电中性的, 但 可以变成带电粒子,称为离子。后者来自溶解在水中并解离成阳离子和阴离子的物质。
电解质溶液中物质的电解分离
弱电解质是在水中部分电离的物质。溶液本身被称为“弱电解质”。 弱酸 ,例如 乙酸 ,只有约 1% 的分子在水中离解形成离子,因此是弱电解质,因为它们没有完全 电离 。还有一些盐形成弱电解质,例如 氯化汞(II) ,因为它在水溶液中仅部分电离。
与弱电解质不同,强电解质在水中几乎完全电离(离解)。该溶液本身被称为“强电解质”。
因此,强电解质和弱电解质的区别与水中溶解物质的分离程度有关。
下表显示了电解质1的不同系列 :
| 强电解质 | 低电解质 | |
|---|---|---|
| 酸 | 强酸 : 无机: 高氯酸 (HClO4 ) 、硝酸(HNO3)、硫酸(H2SO4) 、 盐酸 ( HCl ) 、氢溴酸 (HBr )、 氢氧酸(HI)、盐酸(HClO3) 。 溴酸 (HBrO 3 ) |
弱酸 : 多种矿物质: 硫酸 (H2SO3 )、 碳酸( H2CO3 ) 、 硼酸 (H3BO3)、 硫化氢 ( H2S )、大多数 有机物质 |
| 基础 | 强碱 : 无机: 碱金属氢氧化物 和 碱土金属氢氧化物 |
弱碱 : 氨 、大多数有机物质 |
| 盐类 | 经常 | 溴化物 、 碘化物 、 氰化物 、 汞、硫氰酸锌和 镉 |
电解质的电导率
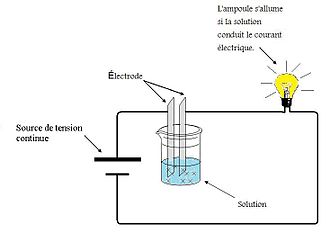
图为 用于测量溶液电导率 的装置。利用该装置可以显示某些材料的水溶液是否导电。这涉及将两个 电极放入 溶液 x中 。当电路闭合时, 如果溶液不传导电流,则灯保持关闭状态;如果溶液传导电流,则灯亮起。 光的强度 根据电解质的强度而变化。
天然电解质
有些电解质被称为天然电解质。 事实上,血液网络中 存在一定的电解质。接下来 我们谈谈 “血液电解质”。其他的 存在于汗液中,因为它含有 钾等电解质元素 。电解质在我们的身体中发挥着非常重要的作用,并确保其正常运作。这些电解质中的每一种都具有特定的功能,并且存在于不同的地方,例如 覆盖细胞并 构成细胞外液 的 血浆 或 间质液。
主要电解质
最臭名昭著的电解质是:
- 盐水( 食盐 NaCl 的水溶液),历史上第一种使用的电解质(1800 年用于伏特电池)。
- 硫酸溶液 ,用于 铅酸电池 。
- 5至8M 钾溶液, 用于镍镉 或 镍氢碱性 电池 。
- 用于锂离子电池的 碳酸酯类有机溶剂混合物中的 LiPF 6溶液 。
- 硫酸铜、 锌 或 镍的硫酸溶液 在硫酸介质中 ,用于具有可溶性阳极的 电解涂层 。
- 用于 铝电合成 的 基于氧化铝 和 冰晶石的熔盐 ( 参见有关电解铝生产 的详细文章 )。