خلاصه
در این مطالعه اثر افزودن الکترولیت بر حذف مواد آلی و مغذی در فاضلاب الکتروشیمیایی با استفاده از الکترود مسی و ویژگیهای محصول جانبی الکترولیز مورد بررسی قرار گرفت. حذف مواد آلی با افزودن یون کلرید به طور قابلتوجهی با زمانهای واکنش کوتاهتر افزایش یافت و بیشتر واکنش الکترولیز در 20 دقیقه تکمیل شد. سرعت واکنش به تدریج متناسب با نسبت Cl-/COD افزایش یافت ، در حالی که بالاترین جرم حذف شده ماده آلی در هر جرم الکترولیت اضافه شده در یک Cl- مشاهده شد .نسبت /COD 1. پس از افزودن الکترولیت، حذف قابل توجهی از نیتروژن آمونیاکی در نتیجه افزایش تولید اکسید کننده هایی مانند هیپوکلریت مشاهده شد. حذف عالی فسفر نیز در زمان واکنش بسیار کوتاه (در عرض 2 دقیقه) توسط انعقاد الکتریکی حاصل شد. با پیشرفت الکترولیز، مقدار محصول جانبی به تدریج افزایش یافت، در حالی که کاهش شاخص حجم لجن پس از افزودن الکترولیت مشاهده شد. این نشان می دهد که عملکرد ته نشینی محصولات جانبی بهتر بوده و حذف آنها به راحتی حاصل می شود.


رفتن به :
1. معرفی
فاضلاب به عنوان آب مصرفی که از منازل مسکونی، مؤسسات و تأسیسات تجاری یا صنعتی تخلیه می شود، تعریف می شود. فاضلاب تصفیه نشده حاوی میکروارگانیسم های بیماری زا متعددی است و تجزیه مواد آلی موجود در آن منجر به ایجاد شرایط آزاردهنده می شود. فاضلاب همچنین حاوی مواد مغذی است که می تواند رشد گیاهان آبزی را تحریک کند و ممکن است حاوی ترکیبات سمی یا بالقوه سرطان زا باشد. به این دلایل، حذف فوری و بدون مزاحمت فاضلاب برای حفاظت از سلامت عمومی و محیط زیست ضروری است [1]. حذف بیولوژیکی مواد مغذی (BNR) معمولاً برای حذف مواد مغذی از فاضلاب استفاده می شود. با این حال، این روش دارای معایبی از جمله عوارض عملیاتی توسط بازیافت لجن داخلی و نیترات، نیاز مداوم به تامین هوا، هزینه های عملیاتی بالا، حساسیت به بارهای سمی شوک، زمان واکنش طولانی تر برای درمان، و حساسیت بالای میکروارگانیسم ها به pH و دما است . 2] .
استفاده از الکتریسیته برای تصفیه آب و فاضلاب برای دفع آلاینده های مرتبط با ترکیبات آلی سمی و ذرات بسیار کوچک بسیار راحت است [3] . با قوانین سختگیرانه زیست محیطی در مورد تخلیه فاضلاب در سال های اخیر، فناوری الکتروشیمیایی به طور گسترده ای در تصفیه انواع فاضلاب مانند نساجی [4-6 ] ، روغن و امولسیون روغن در آب [ 7-9 ] ، لباسشویی استفاده شده است. [10 – 12] ، دام [13 – 15] ، شیرابه [16 – 18] و فاضلاب [2 ، 19 – 20]. استفاده از فناوری الکتروشیمیایی مزایای متعددی از جمله اکسیداسیون قوی، بهره برداری آسان، عدم محدودیت در تغییرات فصلی، قابلیت متغیر برای شار و کیفیت ورودی، و زمان تصفیه سریع نسبت به روش های متداول تصفیه فاضلاب را به همراه دارد.
به طور کلی حذف الکتروشیمیایی آلاینده ها در فاضلاب را می توان از طریق انعقاد الکتریکی یا الکترواکسیداسیون به دست آورد. آلاینده هایی مانند ذرات معلق و مواد حاوی مواد آلی و نیتروژن در فاضلاب را می توان با انعقاد الکتریکی حذف کرد و آلاینده های منعقد شده و لخته شده را با یون های شسته شده از الکترودها جدا کرد [21] . الکترواکسیداسیون را می توان به عنوان یک واکنش الکتروشیمیایی شامل اکسیداسیون مستقیم روی آندها یا اکسیداسیون غیرمستقیم با استفاده از محصولات جانبی مانند هیپوکلریت (HOCl) تعریف کرد و روشی ارزشمند برای حذف آلاینده های محلول است [16 ، 22 ] .
اکثر روش های الکترولیز از یک جفت الکترود فلزی استفاده می کنند و از آنجایی که تصفیه الکتروشیمیایی به آلاینده های موجود در فاضلاب بستگی دارد، انتخاب ماده الکترود بسیار مهم است. در الکترواکسیداسیون، الکترودهای الماس دوپ شده با بور (BDD) و الکترودهای تیتانیوم آبکاری شده با اکسیدهای فلزی مانند SnO 2 ، PbO 2 و TiO 2 به طور کلی مورد استفاده قرار گرفتند [ 22-24 ] . الکترودهای آهن و آلومینیوم نیز در الکترواکسیداسیون، به ویژه برای انعقاد الکتریکی استفاده می شود. به طور کلی، آلومینیوم و آهن به عنوان یک آند نسبتا فعال در ترکیب با یک کاتد نسبتاً پایدار مانند تیتانیوم استفاده میشوند [21] .
در مطالعه قبلی [25] ، الکترودهای مختلفی مانند آلومینیوم، آهن و مس برای تصفیه پساب های نسوز استفاده شد که الکترودهای مسی راندمان بالایی از خود نشان دادند. پتانسیل ردوکس آلومینیوم و آهن به ترتیب 1.662 ولت (برای Al ↔ Al 3+ + 3e – ) و 0.440 ولت (برای Fe ↔ Fe 2+ + 2e − ) است، در حالی که برای مس 0.337 ولت است (برای Cu ↔ Cu 2+ + 2e – ). پتانسیل منفی تر نشان می دهد که الکترود فعال تر است و بنابراین می تواند به راحتی اکسید شده و خورده شود [26]. در مقابل، یک الکترود با پتانسیل مثبت تری مانند مس را می توان بدون تشکیل مقیاس سطحی و فرسودگی سریع نگهداری و مدیریت کرد [25] . بنابراین، حذف مواد معلق در آب و فاضلاب توسط مس می تواند با موفقیت به دست آید، اما مانند الکترودهای آلومینیوم یا آهن، محدودیت هایی در تصفیه آلاینده های محلول داشت [27 ، 28] .
الکترواکسیداسیون آلاینده های محلول در آب و فاضلاب را می توان با تقویت انرژی، مانند جریان الکتریکی یا ولتاژ، که از طریق ناخالصی های موجود در آب جریان می یابد، تقویت کرد. با این حال، برای جلوگیری از حوادث ناشی از شوک الکتریکی باید اقدامات احتیاطی انجام شود. مطالعات متعددی برای افزایش جریان الکتریکی و بهبود بازده الکترواکسیداسیون با افزودن مکمل الکترولیت انجام شده است [ 29-31 ]. نمک معمولاً برای افزایش رسانایی آب یا فاضلاب مورد تصفیه استفاده می شود. مکمل نمک می تواند منجر به بهبود هدایت الکتریکی در آب و همچنین افزایش جریان الکتریکی با کاهش مقاومت شود. این تکنیک می تواند به طور موثر بسیاری از آلاینده های معدنی و آلی را در غلظت های بالای کلرید اکسید کند. اگر میزان کلرید در فاضلاب خام کم باشد، باید مقدار زیادی نمک برای افزایش راندمان فرآیند اضافه شود [ 32-35 ] . در این مطالعه، تأثیر مکمل الکترولیت بر حذف مواد آلی و مغذی در تصفیه فاضلاب الکتروشیمیایی با استفاده از الکترود مسی بررسی شد. ما همچنین ویژگی های محصولات جانبی افزایش جریان الکتریکی را بررسی کرده ایم.
2. بخش تجربی
دستگاه مورد استفاده در این مطالعه از یک راکتور با ظرفیت ~250 میلی لیتر و یک جفت الکترود مسی با منبع تغذیه تشکیل شده است که در شکل 1 ارائه شده است . طول هر الکترود با عرض 10 میلی متر 190 میلی متر بود و بیشتر الکترود در فاضلاب مصنوعی غوطه ور بود. فاصله الکترودها (فاصله بین آند و کاتد) 7.5 میلی متر بود و جفت الکترودها توسط یک گیره پلاستیکی ثابت شدند.
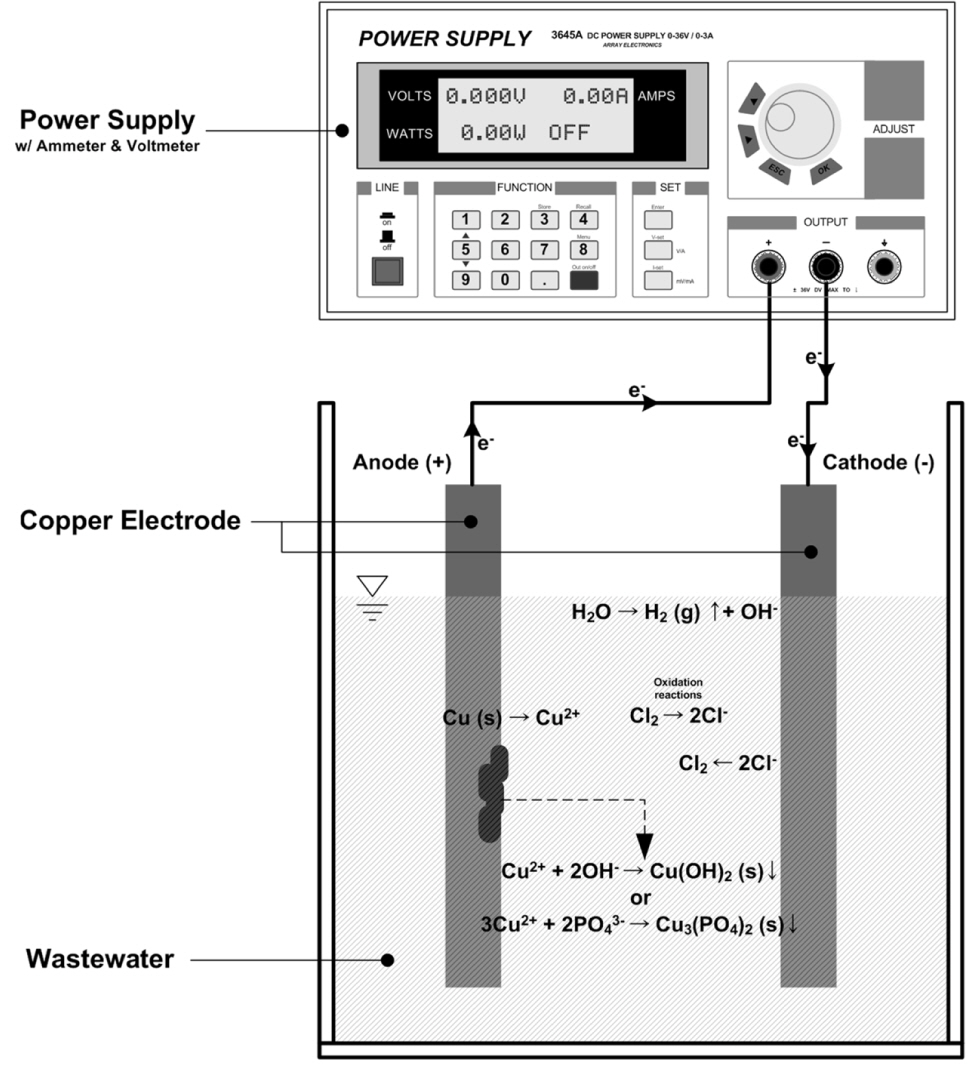 |
عکس. 1.نمودار شماتیک راکتور الکترولیز. |
دو نوع فاضلاب مصنوعی تهیه و مورد استفاده قرار گرفت: نوع A فقط حاوی مواد آلی بود و نوع B حاوی مواد مغذی و همچنین آلی بود. پساب نوع A با غلظت ماده آلی 200 میلی گرم در لیتر به عنوان اکسیژن مورد نیاز شیمیایی (COD) و غلظت های مختلف الکترولیت 200 میلی گرم در لیتر، 400 میلی گرم در لیتر و 800 میلی گرم در لیتر با محلول C 6H تهیه شد . 12 O 6 و کلرید سدیم (NaCl) در آب مقطر، و برای استخراج کلرید بهینه به آلی (Cl- ) استفاده می شود./COD) نسبت برای حذف افزایش یافته مواد آلی. هنگامی که نسبت بهینه کلرید به مواد آلی با استفاده از نوع A مشخص شد، آزمایشهای بیشتری با استفاده از فاضلاب نوع B انجام شد. غلظت آلی، نیتروژن و فسفر در فاضلاب نوع B 200 میلی گرم در لیتر، 40 میلی گرم در لیتر و 10 میلی گرم در لیتر بود که نشان دهنده میانگین غلظت فاضلاب عمومی خانگی است [ 36-41 ] .
آزمایش ها به صورت دسته ای انجام شد. آزمایشات الکتروشیمیایی نیز تحت ولتاژ ثابت 24 ولت و جریان متغیر با حد بالایی 10 آمپر انجام شد. در طول الکترولیز، مقدار جریان بین آند و کاتد به طور همزمان توسط یک ابزار اندازهگیری چندگانه دیجیتال (SEAHAN، SH-852) اندازهگیری شد. همه آنالیزها طبق رویههای روشهای استاندارد انجمن سلامت عمومی آمریکا (APHA) [42] انجام شد . مایع رویی پساب پس از ته نشین شدن به مدت 30 دقیقه به عنوان نمونه برای ارزیابی تصفیه الکتروشیمیایی جمع آوری شد. محصول جانبی الکترولیز خشک و با میکروسکوپ الکترونی روبشی (SEM؛ COXEM، EM-30) و طیفسنجی پراکنده انرژی (EDS؛ BRUKER، XFlash Detector 410-M) آنالیز شد.
3. نتایج و بحث
آلاینده های موجود در فاضلاب را می توان به طور کلی با الکترواکسیداسیون یا انعقاد الکتریکی حذف کرد [21 ، 22] . در مطالعه قبلی ما [25] ، بیشتر مواد آلی را میتوان در فرآیند الکترولیز با جدا کردن محصولات جانبی تشکیلشده در سطح آند توسط انعقاد الکتریکی حذف کرد، و آلایندههای منعقد شده و لختهشده را با یون شستهشده از الکترودها جدا نکرد. در این مطالعه، بنابراین، ما اثر افزودن الکترولیت را تنها بر حذف COD که نشان دهنده آلایندههای آلی در فاضلاب با یونهای کلرید به عنوان الکترولیت است، بررسی کردیم.
الکترواکسیداسیون آلاینده های آلی در فاضلاب می تواند با اکسیداسیون غیرمستقیم یا اکسیداسیون آندی مستقیم رخ دهد. در طول اکسیداسیون الکتروشیمیایی، حذف آلایندههای آلی با اکسیداسیون غیرمستقیم، با استفاده از یون هیپوکلریت و اسید هیپوکلرو تشکیلشده توسط اکسیداسیون آندی کلر در فاضلاب مصنوعی، در نظر گرفته شد. مجموعه ای از واکنش های شامل اکسیداسیون غیر مستقیم در معادلات (1) – (5) نشان داده شده است.
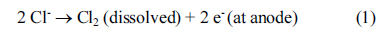
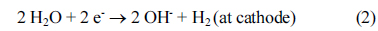
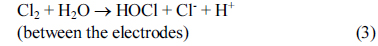

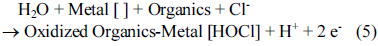
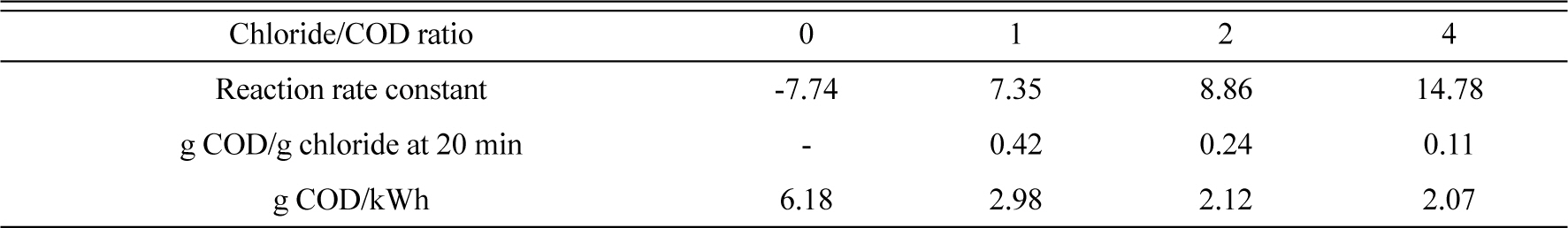
همانطور که در شکل 2 نشان داده شده است، حذف COD می تواند با افزودن یون های کلرید در طول فرآیند الکتروشیمیایی بهبود یابد . Costa و Olivi [43] همچنین گزارش کرده اند که افزودن الکترولیت به محلول منجر به بهبود نرخ اکسیداسیون آلی به دلیل مشارکت یون های هیپوکلریت تولید شده توسط الکترومغناطیسی می شود. در نسبت یون کلر به مواد آلی (Cl- / COD) 2، بالاترین حذف COD را می توان بدون توجه به زمان واکنش به دست آورد. حذف COD بالاتر نیز پس از 5 دقیقه با نسبت Cl- /COD 1 به دست آمد ، در حالی که حذف COD نسبتاً کمتری برای 10 دقیقه مشاهده شد که نسبت Cl- / COD 4 بود. جدول 1ثابتهای سرعت واکنش و بازده انرژی را برای نسبتهای مختلف Cl-/COD نشان میدهد . برای محاسبه ثابتهای سرعت، فرض بر این بود که مواد آلی فعال با سرعت کلی که مستقیماً با غلظت خود در طی عملیات الکتروشیمیایی (یعنی با سینتیک مرتبه اول) متناسب است، تجزیه میشوند. مقادیر ثابتهای سرعت واکنش نیز به تدریج افزایش یافت، زیرا نسبت یونهای کلرید به COD افزایش یافت، و بالاترین مقدار در نسبت Cl-/COD برابر با 4 مشاهده شد. در غیاب یونهای کلرید اضافه شده، واکنش از سینتیک مرتبه اول، و اکسیداسیون نسبتا ضعیفی از مواد آلی مشاهده شد ( شکل 2)). بنابراین، به منظور بهبود حذف مواد آلی با عملیات الکتروشیمیایی، مقدار مناسب یون کلرید اضافه شده ضروری است و می توان آن را از جرم حذف شده ماده آلی به ازای هر جرم اضافه الکترولیت محاسبه کرد. همانطور که در جدول 1 ارائه شده است، حذف بهینه COD به ازای هر الکترولیت اضافه شده در نسبت Cl- / COD برابر با 1 به دست آمد. از سوی دیگر، با افزایش نسبت یون کلرید به COD، بازده انرژی به طور چشمگیری کاهش یافت که نشان می دهد از دست دادن انرژی رخ می دهد. پس از افزودن الکترولیت از این نتایج، نسبت کلرید به مواد آلی 1 برای ارزیابی اثر افزودن الکترولیت برای حذف مواد آلی و مواد مغذی توسط تصفیه فاضلاب الکتروشیمیایی با استفاده از الکترود مسی استفاده شد.
 |
شکل 2.نسبت افزودن الکترولیت بهینه برای بهبود حذف مواد آلی.
|
میز 1.
ثابتهای سرعت واکنش و بازده انرژی در نسبتهای مختلف Cl- / COD.
فاضلاب مصنوعی شامل مواد آلی و همچنین مواد مغذی، که نشان دهنده غلظت معمول فاضلاب از فاضلاب مجزا در کره است، برای ارزیابی اثر افزودن یون کلرید بر حذف مواد آلی استفاده شد (شکل 3) .). برای مقایسه، آزمایشها در غیاب یونهای کلرید اضافه شده نیز انجام شد. با افزایش زمان الکترولیز، حذف کلی مواد آلی از طریق روش الکترولیز افزایش یافت. در غیاب افزودن الکترولیت، ماده آلی در طول زمان الکترولیز اولیه به مدت 5 دقیقه حذف نشد و پس از آن حذف به تدریج افزایش یافت. حذف ماده آلی با افزودن یون های کلرید حتی در زمان های واکنش کوتاه به میزان قابل توجهی افزایش یافت و بیشتر واکنش های الکترولیز در عرض 20 دقیقه تکمیل شد. پس از 20 دقیقه، مقادیر چگالی جریان، pH و پتانسیل کاهش اکسیداسیون (ORP) با وجود روش الکترولیز تقریباً بدون تغییر باقی ماندند.
 |
شکل 3.اثر افزودن یون کلرید بر حذف COD در فاضلاب
|
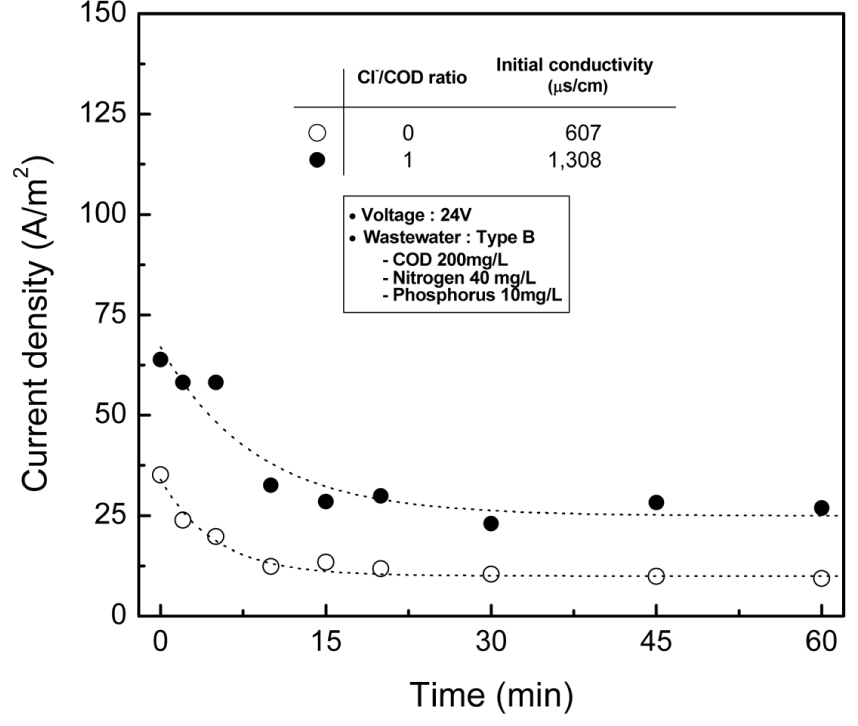
در الکترولیز انجام شده در یک ولتاژ ثابت، چگالی جریان می تواند به دلیل کاهش هدایت الکتریکی در فاضلاب کاهش یابد. رسانایی الکتریکی متقابل مقاومت الکتریکی است و توانایی یک ماده برای هدایت جریان الکتریکی را اندازه گیری می کند [42] . رسانایی الکتریکی نیز با غلظت یون های الکترولیت متناسب است. از این رو، تغییرات در یون های الکترولیت در آب و فاضلاب را می توان با نظارت بر چگالی جریان مشاهده کرد. نمودار تغییرات جریان با زمان واکنش الکترولیز ( شکل 4 ) نشان داد که مقادیر چگالی جریان به تدریج کاهش می یابد. وقتی یون های کلرید اضافه شدند، چگالی جریان تقریباً دو برابر شد. کاهش در چگالی جریان در Cl-نسبت /COD 0 و 1 در زمان واکنش 60 دقیقه به ترتیب 27.4 و 37.0 A/m2 بود . این نشان میدهد که کاهش غلظت یونهای کلرید که بر حذف مواد آلی تأثیر میگذارد، و واکنش تبدیل از کلرید به کلر در فاضلاب همانطور که در رابطه (1) ارائه شده است، با افزودن الکترولیت به طور فعال رخ میدهد. چگالی جریان تنها پس از 20 دقیقه اندکی کاهش یافت، زیرا بیشتر واکنش الکترولیز کامل شد.
 |
شکل 4.تغییرات در چگالی جریان الکتریکی با زمان واکنش الکترولیز.
|
در طول الکترولیز فاضلاب، گاز هیدروژن (H2 ) و هیدروکسید (OH- ) در کاتد تولید می شود، زیرا یون های الکترولیتی زیادی با پتانسیل استاندارد کمتر از هیدروکسید و هیدروژن وجود دارد. به همین دلیل، غلظت یون هیدروکسید در کاتد افزایش می یابد و احتمالاً مقدار pH نیز افزایش می یابد. افزایش مقدار pH توسط یون هیدروکسیل تشکیل شده در کاتد را می توان از نظر تغییر در ORP توسط الکترولیز توضیح داد. از ORP می توان استنباط کرد که واکنش اصلی در آب اکسیداسیون یا کاهش است. نمودار مقدار pH و ORP در مقابل افزودن الکترولیت ( شکل 5) در طول الکترولیز، افزایش در مقدار pH و کاهش در ORP را نشان داد. مقدار pH بالاتر نیز پس از افزودن یون های کلرید مشاهده شد. تغییر pH و ORP را می توان به تولید یون های هیدروکسیل و گاز هیدروژن نسبت داد، زیرا الکترولیز منجر به تجزیه آب در کاتد می شود. مقدار ORP بیشتر به دلیل واکنش پذیری بالا در نتیجه افزودن الکترولیت کاهش یافت.
 |
شکل 5.تغییر مقادیر pH و ORP با افزودن الکترولیت در طول الکترولیز.
|
یونهای مس را میتوان به طور مداوم از آند در طول الکترولیز با استفاده از یک الکترود مسی شستشو داد و محصولات جانبی مانند Cu(OH) 2 ، Cu 2 O و CuO همانطور که نشان داده شده است تولید میشوند.

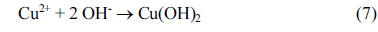
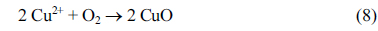
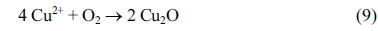
در تصفیه الکتروشیمیایی، پساب نهایی باید پس از جداسازی جامدات از مایع تخلیه شود. از این رو، ویژگی های ته نشینی محصولات جانبی (لجن) که حاوی آلاینده ها یا الکترود شسته شده هستند بسیار مهم است. در این مطالعه، حجم ته نشین شده لجن پس از 30 دقیقه (SV 30 ) و شاخص حجم لجن (SVI) برای ارزیابی ویژگی های ته نشینی محصولات جانبی استفاده شد ( شکل 6 ). SV 30 با قرار دادن نمونه در یک سیلندر 1-2 لیتری و اندازه گیری حجم ته نشین شده پس از 30 دقیقه تعیین شد. SVI غلظت جامد معلق نمونه مربوط به SV 30 است. با پیشرفت الکترولیز، مقدار محصولات جانبی به تدریج افزایش یافت، به ویژه پس از افزودن الکترولیت. با این حال، کاهش SVI پس از افزودن یون کلرید مشاهده شد. مقدار کمتر SVI به طور کلی نشان دهنده ویژگی های ته نشینی بهتر محصولات جانبی است. این نشان می دهد که حذف محصولات جانبی الکترولیز به راحتی انجام می شود.
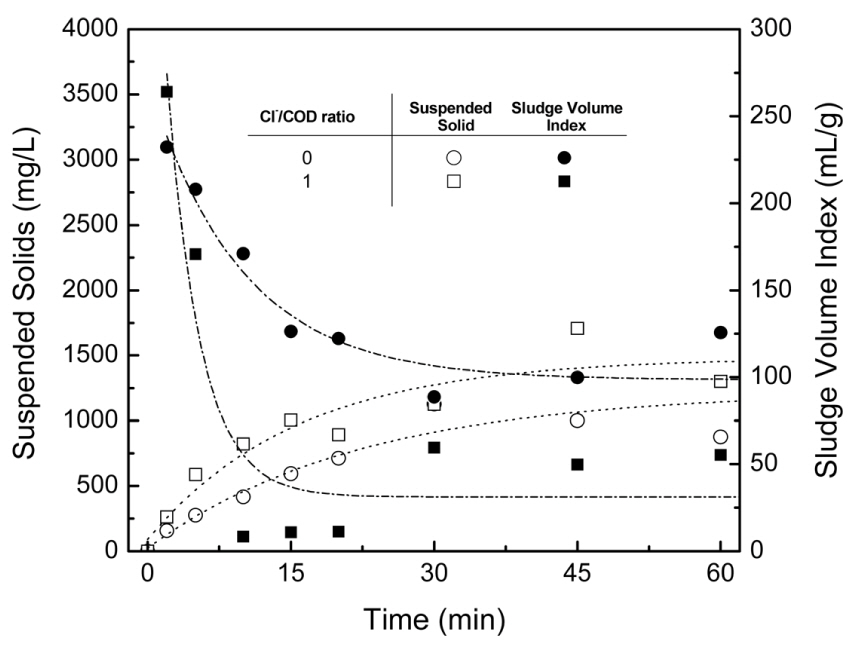 |
شکل 6.غلظت مواد جامد معلق و شاخص حجم لجن محصولات جانبی.
|
رنگ محصولات جانبی در طول الکترولیز از آبی به قهوه ای تیره تغییر کرد. به طور کلی، رنگ محصولات جانبی مس مشکی (CuO)، قرمز (Cu 2 O) و سبز آبی (Cu(OH) 2 یا Cu 3 (PO 4 ) 2 ) است [44] . محصول جانبی خشک شد و توسط طیفسنجی پراکنده انرژی (EDS) آنالیز شد و لجن تولید شده از طریق الکترولیز اولیه حاوی 18.66 در بود. درصد مس، 55.12 در. درصد اکسیژن و 25.48 در. درصد کربن این دلالت بر یک نسبت ترکیبی برای Cu:O بالای 1:2 دارد، و از این رو، محصولات جانبی احتمالا Cu(OH) 2 و Cu 3 (PO 4 ) 2 هستند.. با این حال، محصول جانبی نهایی الکترولیز شامل 46.68 در بود. درصد مس، 52.41 درصد اکسیژن، همراه با مقدار کمی کربن. از این نتیجه، شکل محصول جانبی نهایی CuO است. این نشان می دهد که یون های مس در ابتدای الکترولیز اکسید شده و با یون های هیدروکسید واکنش داده و پس از اتمام الکترولیز با اکسیژن واکنش می دهند. تصاویر میکروسکوپ الکترونی روبشی (SEM) از ریزساختار محصول جانبی توسط SEM نشان داده شده است ( شکل 7 )، که اتصال شل ذرات را نشان می دهد.
 |
شکل 7.تصاویر SEM از محصول جانبی الکترولیز با الکترود مس (الف) در 30 دقیقه و (ب) پس از 60 دقیقه.
|
نیتروژن موجود در فاضلاب را می توان با الکترواکسیداسیون با استفاده از محصولات جانبی مانند هیپوکلریت حذف کرد. کلرید در محیط آبی با الکترولیز به کلر تبدیل می شود و نیتروژن آمونیاکی می تواند توسط هیپوکلریت تولید شده از کلر محلول [45] اکسید شود .
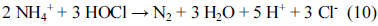
در این مطالعه، یون های کلرید برای افزایش اکسیداسیون نیتروژن و همچنین حذف مواد آلی اضافه شدند و شکل 8 تغییرات نیتروژن آمونیاکی حذف شده را در طول الکترولیز نشان می دهد. حذف نیتروژن آمونیاکی پس از افزودن یون های کلرید به طور قابل توجهی افزایش یافت. در صورت عدم وجود الکترولیت، نیتروژن آمونیاکی در 5 دقیقه اولیه الکترولیز حذف نشد. با این حال، حذف نیتروژن بالاتر پس از افزودن یون کلرید به دست آمد. اکسید کننده ای مانند هیپوکلریت می تواند در زمان واکنش کوتاه تری توسط مکمل اضافی یون کلرید تولید شود و این نتیجه مشابه نتایج Li و همکاران بود . [45] و چو و همکاران . [30]. در الکترولیز، فسفر را می توان با انعقاد الکتریکی از طریق تشکیل ترکیباتی مانند فسفات مس (Cu 3 (PO 4 ) 2 ) خارج کرد. از نمودار حذف فسفر در مقایسه با زمان ( شکل 9 )، مشاهده شد که فسفر به سرعت در مراحل اولیه الکترولیز حذف شد. به طور خاص، حذف فسفر را می توان به طور کامل در یک زمان واکنش بسیار کوتاه (در عرض 2 دقیقه) با افزودن الکترولیت به دست آورد.